Emodinamica 2003; 33:2-10
Remo Albiero
Laboratorio di Emodinamica, Clinica S. Rocco di Franciacorta, Ome (Brescia)
- Introduzione
- Prevenzione delle complicanze
- Caratteristiche angiografiche ad alto rischio
- Conclusioni
- Bibliografia
INTRODUZIONE
Il rischio di un intervento
di rivascolarizzazione coronaria percutanea (PCI) è generalmente valutato
in relazione alla probabilità di un insuccesso procedurale e di complicazioni
ischemiche maggiori (morte, IMA, re-PCI o bypass di emergenza). Tale
rischio dipende dalle condizioni cliniche del paziente, dalle caratteristiche
angiografiche delle lesioni da trattare e da fattori procedurali.
Numerosi studi [1-5] hanno
dimostrato che il rischio della PCI è aumentato in presenza di certe caratteristiche
cliniche (diabete mellito, l'insufficienza renale, la disfunzione del ventricolo
sinistro, problemi ematologici,
una valvulopatia, una vasculopatia cerebrale o periferica, l'età avanzata > 80
anni), e/o di particolari condizioni fisiopatologiche come una sindrome coronarica
acuta (angina instabile o IMA), shock cardiogeno e scompenso cardiaco congestizio.
La presenza di malattie extracardiache concomitanti, oltre ad aumentare il
rischio
della PCI può anche essere una controindicazione all'intervento di bypass di
emergenza in caso di complicazioni durante la PCI.
L'alto rischio di chiusura acuta del vaso associato con l'angioplastica convenzionale
di lesioni
coronariche complesse è stata ridotta dalla possibilità di impianto di stent,
mentre la tecnica di impianto dello stent ad alta pressione (>12 atm) associata
all'uso sistematico della terapia antiaggregante piastrinica con aspirina associata
a ticlopidina/clopidogrel ha drasticamente diminuito a meno dell'1% la temuta
trombosi subacuta [6-8]. L'avvento degli stents di seconda generazione
(pre-montati, più flessibili, di diverse lunghezze) ha poi consentito di espandere
le indicazioni all'impianto di stent a lesioni piú complesse e a maggior rischio
[9] (tronco comune della coronaria sinistra [10],
lesioni calcifiche [11], vasi di diametro < 3 mm [12],
vasi diffusamente malati [13]
in biforcazioni [14], vasi tortuosi, graft arteriosi [15]
e venosi [16]).
Il rischio di una PCI può essere stimato calcolando il numero delle caratteristiche
cliniche, angiografi che e procedurali sfavorevoli presenti [17].
Gli studi più recenti indicano che le variabili cliniche (ad esempio FE < 35%
ed IMA recente) sono più importanti delle variabili angiografiche nel predire
il rischio di complicazioni [18].
PREVENZIONE DELLE COMPLICANZE NELLE PCI
SUI PAZIENTI AD ALTO RISCHIO
La PCI su un paziente ad alto rischio dovrebbe essere eseguita da un operatore
esperto nell'utilizzo degli stents, di strumenti per l'aterectomia e la
trombectomia, e nell'utilizzo di supporti emodinamici come il contropulsatore
aortico [19]. Il rischio della PCI può essere ridotto "prevedendo" le
possibili complicazioni.
È
perciò importante: a) conoscere bene il paziente per prepararlo opportunamente
all'intervento; e b) ripassare sempre mentalmen te la strategia di trattamento
prima dell'intervento.
Di seguito sono elencati i principali fattori di rischio e le misure profilattiche
da adottate per ridurre le possibili complicanze associate:
- in un paziente diabetico è importante una preventiva idratazione, mentre se è in terapia con metformina e valori di creatininemia > 1.5 mg/dl dovrebbe sospendere la terapia con Metformina almeno 24 ore prima e per 48 ore dopo l'intervento per ridurre il rischio di acidosi lattica;
- occorre sempre valutare l'idratazione del paziente, tenendo presente che la deplezione del volume intravascolare aumenta l'effetto ipotensivo del mezzo di contrasto, dei nitrati e dell'ischemia, mentre una eccessiva somministrazione di fluidi per via e.v. può indurre una insufficienza cardiaca nei pazienti con ridotta riserva contrattile del VS;
- gli squilibri elettrolitici andrebbero corretti prima dell'intervento per ridurre il rischio di aritmie;
- in un paziente già in terapia con dicumarolici l'intervento dovrebbe essere differito fino a quando il TP è inferiore a 1,5-1,7 di INR per ridurre il rischio di complicazioni emorragiche;
- nelle PCI ad alto rischio è inoltre importante discutere il caso con il cardiochirurgo prima dell'intervento al fine di programmare le strategie di intervento e le possibili opzioni terapeutiche nel caso si manifestassero delle gravi complicazioni;
- se il paziente ha una insufficienza renale pre-esistente o insufficienza renale anamnestica dopo esposizione a mezzo di contrasto deve essere ben idratato prima e dopo la procedura con soluzione fisiologica. Recenti studi suggeriscono l'uso concomitante di N-acetil cisteina (Fluimucil) o fenoldopam (agonista del recettore dopaminico-1) [20,21]. Oltre all'utilizzo della minima quantità di mezzo di contrasto, in caso di severa insufficienza renale è spesso utile programmare una seduta di dialisi prima e/o subito dopo la PCI;
- un paziente con anatomia coronaria complessa (ad esempio se vi è il rischio di occlusione di rami secondari) dovrebbe essere pre-trattato, in assenza di contro indicazioni, con inibitori del recettore piastrinico GP IIb/IIIa (anti-IIbIIIa), indi pendentemente dal "device" utilizzato per la PCI [22-24]. Il trattamento dovrebbe essere iniziato prima dell'intervento per prevenire le complicazioni, piuttosto che riservarlo al caso in cui la complicazione è già avvenuta;
- in presenza di una severa disfunzione del VS è utile eseguire la procedura con un supporto emodinamico come il contropulsatore aortico al fine di prevenire la comparsa di severa ipotensione. In alternativa si può inserire solamente un introduttore 4 French nell'arteria femorale controlaterale per velocizzare il tempo di inserimento del contropulsatore nel caso fosse richiesto in emergenza;
- in un paziente con turbe maggiori della conduzione AV o nel caso in cui vi sia un aumentato rischio di "no-reflow" (come in presenza di un grosso trombo endoluminale, o interventi su un graft venoso degenerato, o quando venga utilizzato il Rotablator) nel territorio di distribuzione della coronaria destra o circonflessa dominante è utile inserire un pacemaker temporaneo;
- in un paziente con aritmie ventricolari maggiori anamnestiche è utile il posizionamento sulla cute del torace di piastre adesive per la defibrillazione;
- in un paziente ad alto rischio è talvolta utile prevedere la presenza di un anestesista in sala di emodinamica per garantire sia una adeguata sedazione ed analgesia del paziente che una eventuale rapida intubazione in caso di arresto cardiocircolatorio e rianimazione cardio-polmonare.
Il successo della procedura dipende anche dalla adeguata selezione del materiale per angioplastica.
Sono elencate di seguito le principali indicazioni al riguardo:
- l'impianto elettivo di uno stent è il più semplice approccio per ridurre la probabilità di occlusione acuta del vaso e la restenosi a distanza [25]; l'operatore deve decidere il tipo di stent più appropriato per il paziente e la lesione da trattare: è perciò necessaria una conoscenza delle diverse caratteristiche dei singoli stent attualmente disponibili sul mercato [26], che li rende più o meno adatti per particolari tipi di lesioni coronariche complesse e a maggior rischio di complicazioni: quelle in curva, le lesioni ostiali, in sede di biforcazione, sul tronco comune, le lesioni calcifiche, le occlusioni totali, nei piccoli vasi, nei graft venosi, quando vi è una minaccia di occlusione del vaso, o in sitazioni speciali come un aneurisma;
- è utile usare un catetere guida di diametro maggiore di 6 French in caso di IMA. Questo accorgimento permette:
- di utilizzare sistemi/ cateteri trombo-aspiranti (spesso 8F compatibili);
- di eseguire un "kissing balloon" su una biforcazione in cui la branca laterale abbia un diametro superiore a 2 mm;
- di eseguire (solo se necessario) un intervento di aterectomia (DCA o Rotablator);
- il Rotablator è un importante strumento utilizzato prima dell'impianto di stent soprattutto in lesioni fibrocalcifiche non dilatabili con il solo palloncino da angioplastica;
- i sistemi di protezione dalla embolizzazione distale dovrebbero essere sempre usati in corso di interventi su graft venosi degenerati;
- talora sono necessarie tecniche di imaging aggiuntive come l'eco intravascolare (IVUS), molto utile per ottimizzare il risultato finale [27];
- nel laboratorio non dovrebbero mancare dei palloncini da perfusione da utilizzare quando sono richiesti gonfiaggi prolungati per trattare perforazioni, in particolare quando non è possibile l'impianto di uno stent ricoperto da PTFE.
Un altro fattore importante nelle PCI ad alto rischio è l'abilità manuale
e la capacità decisionale intra-procedurale dell'operatore, il quale:
- deve lavorare velocemente e manipolare correttamente il catetere guida per evitare periodi di ischemia prolungata. Una scorretta manipolazione del catetere guida può indurre ischemia miocardia mediante trauma dell'ostio coronario, ostruzione del flusso da intubazione profonda della coronaria; anche la scelta di un catetere guida di diametro maggiore rispetto a quello della coronaria incannulata può causare lo stesso effetto;
- adottare la filosofia di raggiungere lo scopo "principale" dell'intervento, accettando di non completare come previsto la procedura quando il rapporto rischio/beneficio è sfavore vole. In altre parole, nei pazienti ad alto rischio l'operatore deve essere in grado di modificare rapidamente la strategia iniziale, sapendo quando deve fermarsi per salvaguardare la salute del paziente, e anche se a scapito del mancato raggiungimento del risultato ottimale che si era prefissato di ottenere.
Non bisogna poi trascurare
il decorso intra-ospedaliero succes sivo all'intervento che va curato
in modo particolarmente accurato. I pazienti ad alto rischio dovrebbero
essere trasferiti in una unità dotata di telemetria dopo la PCI. Una
notte di osservazione in UTIC è preferibile nei casi in cui la procedura è complicata
da un risultato angiografico subottimale o se vi è necessità di mantenere
in funzione il pacemaker o il contropulsatore aortico. Il monitoraggio
emodinamico invasi vo dovebbe essere continuato fino a quando il paziente
non si è stabilizzato, di solito per almeno 24 ore.
Infine, occorre pensare anche al follow-up a distanza: è buona norma per esempio
considerare un follow-up angiografico elettivo in pazienti con una lesione
trattata sul tronco comune, oppure nel caso vengano trattate più lesioni lunghe
in vasi piccoli ed in più di un vaso coronarico.
CARATTERISTICHE ANGIOGRAFICHE PREDITTIVE
DI AUMENTATO RISCHIO DI COMPLICAZIONI E STRATEGIE DI RIDUZIONE
DEL RISCHIO.
Le lesioni ideali per una PCI sono quelle isolate, focali, non-calcifiche, prossimali, non occlusi ve e concentriche. In queste lesioni "semplici", vi è un basso rischio di complicazioni peri-procedurali. Al contrario, le lesioni coronariche più complesse (occlu sioni totali, lesioni fibro-calcifiche, in curva >60 gradi, lesioni complicate da un trombo endoluminale, lesioni a livello di una biforcazione, sul tronco comune (TC), in un graft venoso, lesioni lunghe, in vasi piccoli ed estremamente tortuosi) sono assoc iate ad un aumentato rischio di complicazioni peripro cedurali. Va comunque ricordato che le caratteristiche angiografiche sfavorevoli sono meno importanti come fattore predittivo di compli cazioni peri-procedurali ischemi che rispetto alle variabili cliniche (ad esempio FE <35% o IMA recente) [18].
1. Lesioni su tronco comune non protetto
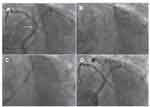
La malattia del TC della coronaria sinistra è presente nel 7% e 15% dei pazienti con angina stabile e instabile, rispettivamente. La PTCA tradizionale del TC non protetto è tecnicamente fattibile, ma è associata ad un'alta mortalità procedurale e a distanza [28-30]. Risultati più favore voli sono stati ottenuti con l'impianto di stent in numerosi studi non randomiz zati [29,31-35], sebbene sia stata rilevata al follow-up ad un anno una percentuale fino al 20% di eventi maggiori (morte e ricorso al bypass) [34,35]. Per questo si suggerisce di eseguire la PCI su TC non protetto solo a pazienti che rifiutano o sono stati già sottoposti ad intervento di bypass, o che non sono dei buoni candidati per la chirurgia. La figura 1 illustra un tipico esempio di PCI del TC distale in un paziente già operato di bypass con arteria mammaria interna (AMI) sul ramo diagonale stenotico all'ostio e graft venoso sulla coronaria destra: i due graft erano pervi, ma era ricomparsa un'angina fortemente instabile dovuta ad ischemia nel territorio dell'arteria discendente anteriore e del ramo intermedio.
| Figura 1. PCI del TC distale in un pz già operato di duplice bypass (AMISx sul ramo diagonale stenotico all'ostio e graft di vena safena sulla coronaria dx distale): i due graft erano pervi, ma era ricomparsa un'angina fortemente instabile per ischemia nel territorio dell'arteria discendente anteriore (DA) e del ramo intermedio. A, Stenosi critica nel tratto distale del TC della coronaria sx prima della triforcazione in arteria circonflessa (CX, occlusa nel tratto medio), arteria DA e ramo intermedio. B, Passaggio di 2 fili guida nella DA e nel ramo intermedio e posizionamento di uno stent Tecnic Carbostent sul TC distale verso l'ostio della DA. C, Gonfiaggio simultaneo di 2 palloncini da angioplatica ("kissing balloon") sul TC dopo espansione dello stent sul TC-DA e PTCA sul ramo intermedio passando attraverso le maglie dello stent. D, Risultato angiografico finale dopo "kissing balloon". |
2. Lesioni in graft venosi degenerati
Nelle stenosi presenti
su
graft venosi degenerati vi è un alto rischio del fenomeno del no-reflow legato
alla embolizzazione distale del materiale non trombotico contenuto nel graft
[36]. Con l'utilizzo di palloncini occlusivi (sistema PercuSurge)
o di filtri protettivi montati distalmente a fili guida da angioplastica, come
nel caso illustrato in figura 2, tale rischio è stato significativamene ridotto,
per cui tali sistemi dovrebbe essere sempre utilizzati (quando possibile) durante
una
PCI su un graft venoso degenerato.
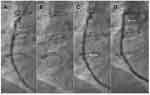
| Figura 2. Utilizzo di un filtro per la protezione della embolizzazione distale in corso di PCI su una lesione stenotica in un graft venoso degenerato. A, Stenosi critica nel tratto prossimale (freccia) di un graft venoso in vena safena sul ramo bdiscendente posteriore della coronaria dx. B, Posizionamento del filtro (EpiFilter wire, Boston Scientific) distalmente alla lesione da trattare. Il filtro non è stato ancora espanso, ed è racchiuso (freccia) all'interno del catetere di posizionameno ("delivery catheter"). C, filtro espanso (freccia) dopo aver retratto il "delivery catheter". D, risultato angiografico finale con normale flusso TIMI 3 dopo impianto di stent nel tratto prossimale del graft (freccia) e rimozione del filtro. |
3. Lesioni complicate da trombo endoluminale
Rispetto ai pazienti
con angina stabile, i pazienti con sindrome coronarica acuta (angina
instabile o infarto miocardio acuto) sono a maggior rischio di complicazioni
per la presenza di placche ulcerate e trombotiche (fenomeno del no-reflow
[36]), per il loro stato ipercoagulativo, e perchè spesso
non sono trattati con antiag greganti piastrinici quando giungo no
nel laboratorio di emodinamica. Numerosi studi randomizzati hanno ormai
definitivamente dimostrato che nei pazienti sottoposti
a PCI vi è una significativa riduzione degli eventi cardiaci avversi (morte,
infarto miocardico, reintervento, bypass di emergenza, o impianto di stent) quando
vengono trattati con anti IIb/IIIa rispetto a quelli trattati con placebo [22-24].
L'utilizzo di sistemi di aspirazione del trombo (trombectomia) come illustrato
in figura 3, o di sistemi di protezione dalla embolizzazione distale (filtri
o palloni occlusivi), associata o meno all'uso di anti GP IIbIIIa, ha ridotto
il rischio di embolizzazione distale e del fenomeno del no-reflow.
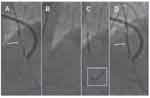
| Figura 3. Aspirazione di due piccoli trombi endoluminali (trombectomia) in un paziente con angina fortemente instabile insorta più di 48 ore prima. A, l'angiografia della coronaria sinistra evidenzia due difetti di riempimento (freccie) da verosimile trombosi endoluminale a monte di una stenosi serrata dell'arteria discendente anteriore. B, mediante utilizzo di un catetere dedicato per tromboaspirazione vengono rimossi entrambi i trombi (con aspetto di trombo organizzato). |
4. Pazienti con lesioni multivasali e circoli collaterali
La complessità di una lesione dipende anche dalla presenza di altre stenosi coronariche e di circoli collaterali. Il numero di vasi da trattare aumenta il rischio di complicazioni anche se con l'uso dello stent questo rischio si è ridotto. La stadiazione della procedura può essere un mezzo per ridurre il rischio di complicazioni in alcuni pazienti con malattia multivasale in cui questo rischio sia particolarmente elevato. Se il vaso da trattare fornisce collaterali ad un altro vaso coronarico occluso, il rischio della procedura è aumentato, soprattutto quando l'arteria da trattare è il solo vaso coronarico pervio e/o si distribuisce ad un esteso territorio miocardio: in questi casi, anche se la lesione da dilatare è di per se stessa semplice (focale, concentrica, non calcifica), l'intervento deve essere considerato complesso e a rischio di gravi complicazioni (e di morte) nel caso di occlusione acuta. Quando si intende comunque trattare questi pazienti ad alto rischio, si consiglia di posizionare nell'arteria femorale controlaterale un introduttore arterioso 4 French o direttamente il contropulsatore aortico [37].
Sebbene l'impianto di stent abbia ridotto il rischio di occlusione acuta del vaso, il rischio rimane elevato quando l'impianto dello stent risulta difficoltoso come in caso di:
- Tortuosità del vaso prossimale che si può associare a difficile accesso alla lesione con il filo guida e il sistema di dilatazione;
- Lesioni fibro-calcifiche che pongono difficoltà ad attraversare la lesione con il filo guida e il sistema di dilatazione (pallone/aterotomo /stent) o a dilatarla;
- Lesioni ostiali ed in sede di biforcazione in cui vi è il rischio di shift di placca con compromissione/occlusione di una delle due branche della biforcazione;
1) Tortuosità prossimale ed accessibilità della lesione
Il miglioramento degli
strumenti a disposizione del cardiologo interventista (cateteri guida,
fili guida e cateteri a palloncino) ha reso più semplice l'accesso
alle lesioni complesse. In vasi tortuosi con lesioni molto distali è importante
selezionare il materiale più adatto alla procedura che si deve eseguire.
In alcuni pazienti con vasi estremamente tortuosi o curve prossimali
alla lesioni molto angolate, può essere difficile il passaggio anche
del filo guida, soprattutto nel caso in cui vi sono delle curve in
serie. In queste circostanze è meglio usare un filo guida idrofilico
e flessibile rispetto ad un filo guida rigido. Vi sono comunque alcuni
operatori che utilizzano sempre in questi casi dei fili guida rigidi
ad alto supporto, che sicuramente garantiscono la stabilità del sistema
catetere guida/sistema di dilatazione, ma spesso non agevolano il passaggio
dello stent attraverso la curve del vaso prossimali alla lesione (perchè creano
pseudolesioni da rettilineizzazione del vaso). Potrebbe essere invece
più vantaggioso utilizzare un catetere guida ad alto supporto (curva
XB, EBU o AL invece della tradizionale curva JL) e fili guida più flessibili
e idrofilici ( esempio Choice PT).
Un filo guida ad alto supporto può essere eventualmente fatto avanzare in parallelo
al filo guida più flessibile e posizionato in una branca del vaso prossimale
al tratto tortuoso da attraversare: in questo modo si aumenta il supporto del
catetere guida senza compro mettere il passaggio del palloncino da angioplastica
e dello stent soprattutto attraverso curve molto angolate come nell'esempio
illustrato in figura 4.
La capacità di raggiungere e dilatare la lesione con il palloncino e/o lo stent
dipende oltre che dal grado di angolazione della curva da attraversare, anche
dal tipo di pallone/stent utilizzato.
Rispetto ad esempio agli stent di prima generazione (quello tubulare di Palmaz-Schatz
e quello filiforme di Gianturco-Rubin), gli stents di ultima generazione (premontati
sul palloncini da angioplastica con alta "trackability", flessibili e a basso
profilo) hanno notevolmente aumentato la probabilità di successo nel trattamento
delle lesioni più complesse.
| Figura 4. A, Stenosi serrata (freccia) nel tratto medio dell'arteria DA, occlusa subito dopo l'origine dal TC. Tre importanti rami settali e il primo ramo diagonale non vengono perciò sufficientemente perfusi dal graft venoso (pervio) anastomizzato nel tratto medio-distale della DA. B, un filo guida a medio supporto (BMW, Guidant) è stato fatto avanzare nel tratto distale della DA (prossimamente al tratto molto angolato da attraversare) in parallelo ad un filo guida idrofilico e più flessibile (Choice PT, Boston Sciertific) che è stato fatto avanzare in via retrograda nella DA media fino all'interno del primo ramo settale. C, angioplastica nel tratto medio della DA e sull'anastomosi del graft a livello della curva molto angolata di quasi 180°. D, Risultato finale dopo impianto di uno stent Medtronic AVE nel tratto medio della DA. In questo caso il filo guida a medio supporto ha notevolmente facilitato il successivo posizionamento in via retrograda sulla DA media del filo guida più flessibile che ha facilitato il passaggio del palloncino da angioplastica e l'impianto di stent. |
2) Lesioni fibro-calcifiche e dilatabilità della lesione
Le lesioni fibro-calcifiche
ed eccentriche sono a maggior rischio di non essere completamente dilatate
mediante PTCA tradizionale.
Inoltre, in questo tipo di lesioni sono più frequenti le complicazioni come
dissezioni, occlusioni trombotiche o recoil elastico del vaso [38,39].
Nei pazienti con questo tipo di lesioni, la possibilità di impianto di stent
ha ridotto le complicanze procedurali e la necessità del ricorso al bypass
di emergenza.
È
contro indicato comunque impiantare uno stent in una lesione fibro-calcifica
che non si dilata completamente con il palloncino da angioplastica, ed è talora
molto rischioso utilizzare la tecnica di impianto diretto (senza predilatazione)
di stent in lesioni possibilmente fibro-calcifiche che si possono dimostrare
poi indilatabili.
In questo tipo di lesioni è importante disporre del cutting balloon o dell'aterectomia
rotazionale11 per trattare la lesione con successo prima dell'impianto dello
stent.
3) Lesioni in sede di biforcazione ed ostiali
Quando si tratta una
biforca zione, aumenta il rischio di com promettere una delle due branche.
Nella figura 5 è illustrato un caso di occlusione del tronco comune
a valle della quale era presente una stenosi all'ostio dell'arteria
DA e dell'arteria Cx. In questo caso la riapertura del TC era associata
ad un alto rischio di infarto in caso di compromissione dell'ostio
della arteria Cx. Nelle biforcazioni non associate ad occlusione prossima
le, se la branca minore della biforcazione è stenotica alla sua origine,
il rischio di occlusione di tale branca durante angioplastica è compreso
tra il 14% e 27% [40,41]. Le tecniche sempre più complesse
utilizzate per il trattamento delle biforcazioni: dalla PTCA tradizio
nale all'utilizzo del cutting bal loon, dell'aterectomia direzionale
[42] e rotazionale, fino all'impianto di stent con
tecnica a V, a Y, a T [43], a culotte, a gonna [44]
richiedono una maggior esperienza dell'operatore rispetto a quella
richiesta per il trattamento di lesioni in segmenti non biforcati.
Nel caso di impianto di stent, si raccomanda attualmente di limitare
se possibile l'impianto di stent alla branca principale, dilatando
con palloncino la branca minore, e di eseguire sistematica mente un
gonfiaggio contempora neo finale con 2 palloncini su entrambe le branche
("kissing balloon") [14] per evitare che lo stent
nel vaso
principale venga deforma to dopo che è stata dilatata la branca secondaria. Le
lesioni ostia li (aorto-ostiali o in sede di biforca zione) si dilatano spesso
in modo subottimale anche dopo impianto di stent, presentando spesso un marcato
recoil elastico. Per questo necessitano talvolta di un pre-trattamento con cutting
balloon, o mediante aterectomia rotazionale o direzionale (se il diametro del
vaso è abbastanza grande). L'aterectomia facilita la successiva dilatazione del
vaso ed riduce la probabilità di spostamento della placca dopo il successivo
impianto di stent.
| Figura 5. Ricanalizzazione ad alto richio del TC della coronaria sx. A, Occlusione completa di vecchia data del TC (freccia). B, stenosi all'ostio dell'arteria DA e dell'arteria CX (freccia) visualizzate attraverso iniezione nell'arteria mammaria interna sinistra, pervia, ed anastomizzata nel tratto medio della DA. C, Risultato angiografico finale dopo riapertura del TC con corretto passaggio del filo guida rigido utilizzato (Cross-it 200) nella CX e impianto di stent sul TC-ostio della CX. In questo caso la riapertura del TC era associata ad un alto rischio di infarto in caso di compromissione dell'ostio dell'arteria circonflessa. |
In questo articolo
sono state esaminate le condizioni cliniche, le caratteristiche angiografiche
delle lesioni da trattare e i fattori procedurali che incrementano
il rischio di complicazioni ischemiche maggiori nei pazienti sottoposti
a PCI, analizzando nelle singole circostanze le strategie per la riduzione
del rischio.
- Thel MC, Califf RM, Tcheng JE, Sigmon KN, Lincoff AM, Topol EJ, Ellis SG. Clinical risk factors for ischemic complications after percuta neous coronary interventions: results from the EPIC trial. The EPIC Investigators. Am Heart J. 1999;137:264-73.
- King SB, 3rd, Yeh W, Holubkov R, Baim DS, Sopko G, Desvigne-Nickens P, Holmes DR, Jr., Cowley MJ, Bourassa MG, Margolis J, Detre KM. Balloon angioplasty versus new device intervention: clinical outcomes. A comparison of the NHLBI PTCA and NACI registries. J Am Coll Cardiol. 1998;31:558-66.
- Garot P, Himbert D, Juliard JM, Golmard JL, Steg PG. Incidence, consequences, and risk factors of early reocclusion after primary and/or rescue percutaneous transluminal coronary angioplasty for acute myocardial infarction. Am J Cardiol. 1998;82:554-8.
- Maynard C, Chapko MK, Every NR, Martin DC, Ritchie JL. Coronary angioplasty outcomes in the Healthcare Cost and Utilization Project, 1993-1994. Am J Cardiol. 1998;81:848-52.
- Waksman R, Ghazzal ZM, Baim DS, Steenkiste AR, Yeh W, Detre KM, King SB, 3rd. Myocardial infarction as a complication of new interventional devices. Am J Cardiol. 1996;78:751-6.
- Albiero R, Hall P, Itoh A, Blengino S, Nakamura S, Martini G, Ferraro M, Colombo A. Results of a consecutive series of patients receiving only antiplatelet therapy after optimized stent implantation. Comparison of aspirin alone versus combined ticlopidine and aspirin therapy. Circulation. 1997;95:1145-56.
- Colombo A, Hall P, Nakamura S, Almagor Y, Maiello L, Martini G, Gaglione A, Goldberg SL, Tobis JM. Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance. Circulation. 1995;91:1676-88.
- Leon MB, Baim DS, Popma JJ, Gordon PC, Cutlip DE, Ho KK, Giambartolomei A, Diver DJ, Lasorda DM, Williams DO, Pocock SJ, Kuntz RE. A clinical trial comparing three antithrombotic-drug regimens after coronary- artery stenting. Stent Anticoagulation Restenosis Study Investigators. N Engl J Med. 1998;339:1665-1671.
- Finci L, Ferraro M, Nishida T, Albiero R, Corvaja N, Vaghetti M, Stankovic G, Recchia M, Di Mario C, Colombo A. Coronary stenting beyond standard indications. Immediate and follow-up results. Ital Heart J. 2000;1:739-48.
- Anzuini A, Rosanio S, Di Mario C, Tocchi M, Carlino M, De Gregorio J, Colombo A. Interventional revascularization of left main coronary artery stenosis with new devices: two cases of "unprotected" left main stenosis treated with atherectomy and stenting. Am J Med Sci. 2000;319:314-319.
- Moussa I, Di Mario C, Moses J, Reimers B, Di Francesco L, Martini G, Tobis J, Colombo A. Coronary stenting after rotational atherectomy in calcified and complex lesions. Angiographic and clinical follow-up results. Circulation. 1997;96:128-36.
- Akiyama T, Moussa I, Reimers B, Ferraro M, Kobayashi Y, Blengino S, Di Francesco L, Finci L, Di Mario C, Colombo A. Angiographic and clinical outcome following coronary stenting of small vessels: a comparison with coronary stenting of large vessels. J Am Coll Cardiol. 1998;32:1610-1618.
- Moussa II, De Gregorio J, Di Mario C, Colombo A. The Use of Intravascular Ultrasound and Spot Stenting for the Treatment of Long Lesions and Small Vessels. J Invasive Cardiol. 1999;11:47-55.
- Yamashita T, Nishida T, Adamian MG, Briguori C, Vaghetti M, Corvaja N, Albiero R, Finci L, Di Mario C, Tobis JM, Colombo A. Bifurcation lesions: two stents versus one stent--immediate and follow- up results. J Am Coll Cardiol. 2000;35:1145-51.
- Albiero R, Nishida T, Corvaja N, Vaghetti M, Di Mario C, Colombo A. Left internal mammary artery graft perforation repair using polytetrafluoroethylene-covered stents. Catheter Cardiovasc Interv. 2000;51:78-82.
- Nishida T, Colombo A, Briguori C, Adamian M, Finci L, Albiero R, Ferraro M, Di Mario C. Contemporary percutaneous treatment of saphenous vein graft stenosis: immediate and late outcomes. J Invasive Cardiol. 2000;12:505-12.
- Kimmel SE, Berlin JA, Strom BL, Laskey WK. Development and validation of simplified predictive index for major complications in contemporary percutaneous transluminal coronary angiopla sty practice. The Registry Committee of the Society for Cardiac Angiography and Interventions. J Am Coll Cardiol. 1995;26:931-8.
- Rihal CS, Grill DE, Bell MR, Berger PB, Garratt KN, Holmes DR, Jr. Prediction of death after percutaneous coronary interventional proce dures. Am Heart J. 2000;139:1032-8.
- Hirshfeld JW, Jr., Ellis SG, Faxon DP. Recommendations for the assessment and maintenance of proficiency in coronary interventional procedures: Statement of the American College of Cardiology. J Am Coll Cardiol. 1998;31:722-43.
- Solomon R, Werner C, Mann D, D'Elia J, Silva P. Effects of saline, mannitol, and furosemide to prevent acute decreases in renal function induced by radiocontrast agents. N Engl J Med. 1994;331:1416-20.
- Stevens MA, McCullough PA, Tobin KJ, Speck JP, Westveer DC, Guido-Allen DA, Timmis GC, O'Neill WW. A prospective randomized trial of prevention measures in patients at high risk for contrast nephropathy: results of the P.R.I.N.C.E. Study. Prevention of Radiocontrast Induced Nephropathy Clinical Evaluation. J Am Coll Cardiol. 1999;33:403-11.
- Lincoff AM, Califf RM, Anderson KM, Weisman HF, Aguirre FV, Kleiman NS, Harrington RA, Topol EJ. Evidence for prevention of death and myocardial infarction with platelet membrane glycoprotein IIb/IIIa receptor blockade by abciximab (c7E3 Fab) among patients with unstable angina undergoing percutaneous coronary revascularization. EPIC Investigators.Evaluation of 7E3 in Preventing Ischemic Complications. J Am Coll Cardiol. 1997;30:149-56.
- Investigators TE. Randomised placebo-controlled and balloon-angioplasty-controlled trial to assess safety of coronary stenting with use of platelet glycoprotein-IIb/IIIa blockade. Lancet. 1998;352:87-92.
- Weintraub WS, Culler S, Boccuzzi SJ, Cook JR, Kosinski AS, Cohen DJ, Burnette J. Economic impact of GPIIB/IIIA blockade after high-risk angioplasty: results from the RESTORE trial. Randomized Efficacy Study of Tirofiban for Outcomes and Restenosis. J Am Coll Cardiol. 1999;34:1061-6.
- Versaci F, Gaspardone A, Tomai F, Crea F, Chiariello L, Gioffre PA. A comparison of coronary-artery stenting with angioplasty for isolated stenosis of the proximal left anterior descending coronary artery. N Engl J Med. 1997;336:817-22.
- Colombo A, Stankovic G, Moses JW. Selection of coronary stents. J Am Coll Cardiol. 2002;40:1021-33.
- Oesterle SN, Whitbourn R, Fitzgerald PJ, Yeung AC, Stertzer SH, Dake MD, Yock PG, Virmani R. The stent decade: 1987 to 1997. Stanford Stent Summit faculty. Am Heart J. 1998;136:578-99.
- Ellis SG, Tamai H, Nobuyoshi M, Kosuga K, Colombo A, Holmes DR, Macaya C, Grines CL, Whitlow PL, White HJ, Moses J, Teirstein PS, Serruys PW, Bittl JA, Mooney MR, Shimshak TM, Block PC, Erbel R. Contemporary percutaneous treatment of unprotected left main coronary stenoses: initial results from a multicenter registry analysis 1994-1996. Circulation. 1997;96:3867-72.
- Marso SP, Steg G, Plokker T, Holmes D, Park SJ, Kosuga K, Tamai H, Macaya C, Moses J, White H, Verstraete SF, Ellis SG. Catheter-based reperfusion of unprotected left main stenosis during an acute myocardial infarction (the ULTIMA experience). Unprotected Left Main Trunk Intervention Multi-center Assessment. Am J Cardiol. 1999;83:1513-7.
- Kosuga K, Tamai H, Ueda K, Hsu YS, Kawashima A, Tanaka S, Matsui S, Hata T, Minami M, Nakamura T, Toma M, Motohara S, Uehata H. Initial and long-term results of angioplasty in unprotected left main coronary artery. Am J Cardiol. 1999;83:32-7.
- Kornowski R, Klutstein M, Satler LF, Pichard AD, Kent KM, Abizaid A, Mintz GS, Hong MK, Popma JJ, Mehran R, Leon MB. Impact of stents on clinical outcomes in percutaneous left main coronary artery revascularization. Am J Cardiol. 1998;82:32-7.
- Laruelle CJ, Brueren GB, Ernst SM, Bal ET, Mast GE, Suttorp MJ, Brutel de la Riviere A, Plokker TH. Stenting of "unprotected" left main coronary artery stenoses: early and late results. Heart. 1998;79:148-52.
- Park SJ, Park SW, Hong MK, Cheong SS, Lee CW, Kim JJ, Mintz GS, Leon MB. Stenting of unprotected left main coronary artery stenoses: immediate and late outcomes. J Am Coll Cardiol. 1998;31:37-42.
- Silvestri M, Barragan P, Sainsous J, Bayet G, Simeoni JB, Roquebert PO, Macaluso G, Bouvier JL, Comet B. Unprotected left main coronary artery stenting: immediate and medium-term outcomes of 140 elective procedures. J Am Coll Cardiol. 2000;35:1543-50.
- Wong P, Wong V, Tse KK, Chan W, Ko P, Wong CM, Leung AW, Fong PC, Cheng CH, Tai YT, Leung WH, Liu ML. A prospective study of elective stenting in unprotected left main coronary disease. Catheter Cardiovasc Interv. 1999;46:153-9.
- Resnic FS, Wainstein M, Lee MK, Behrendt D, Wainstein RV, Ohno-Machado L, Kirshenbaum JM, Rogers CD, Popma JJ, Piana R. No-reflow is an independent predictor of death and myocardial infarction after percutaneous coronary intervention. Am Heart J. 2003;145:42-6.
- Kahn JK, Rutherford BD, McConahay DR, Johnson WL, Giorgi LV, Hartzler GO. Supported "high risk" coronary angioplasty using intraaortic balloon pump counterpulsation. J Am Coll Cardiol. 1990;15:1151-5.
- Myler RK, Shaw RE, Stertzer SH, Hecht HS, Ryan C, Rosenblum J, Cumberland DC, Murphy MC, Hansell HN, Hidalgo B. Lesion morphology and coronary angioplasty: current experience and analysis. J Am Coll Cardiol. 1992;19:1641-52.
- Ellis SG. Coronary lesions at increased risk. Am Heart J. 1995;130:643-6.
- Meier B, Gruentzig AR, Hollman J, Ischinger T, Bradford JM. Does length or eccentricity of coronary stenoses influence the outcome of transluminal dilatation? Circulation. 1983; 67:497-9.
- Vetrovec GW, Cowley MJ, Wolfgang TC, Ducey KC. Effects of percutaneous transluminal coronary angioplasty on lesion- associated branches. Am Heart J. 1985; 109:921-5.
- Karvouni E, Di Mario C, Nishida T, Tzifos V, Reimers B, Albiero R, Corvaja N, Colombo A. Directional atherectomy prior to stenting in bifurcation lesions: A matched comparison study with stenting alone. Catheter Cardiovasc Interv. 2001; 53:12-20.
- Sheiban I, Albiero R, Marsico F, Dharmadhikari A, Tzifos V, Pagnotta P, Montorfano M, Leonardo F, Saba P, Di Mario C, Colombo A. Immediate and long-term results of "T" stenting for bifurcation coronary lesions. Am J Cardiol. 2000;85:1141-4, A9.
- Kobayashi Y, Colombo A, Adamian M, Nishida T, Moussa I, Moses JW. The skirt technique: A stenting technique to treat a lesion immediately proximal to the bifurcation (pseudobifurcation). Catheter Cardiovasc Interv. 2000;51:347-51.